<190427 금속재료기사>
2021.12.31 - [공부/금속재료] - 190427 금속재료기사 금속조직학
2022.01.01 - [공부/금속재료] - 190427 금속재료기사 금속재료학
2022.01.02 - [공부/금속재료] - 190427 금속재료기사 야금공학
2022.01.03 - [공부/금속재료] - 190427 금속재료기사 금속가공학
2022.01.04 - [공부/금속재료] - 190427 금속재료기사 표면공학
41. 다음 리차드 법칙이 나타내는 것

용융점이 높은 금속일수록 많은 융해열이 필요하다.
42. 열역학 제1법칙은 에너지보존의 법칙이다.
43. 돌로마이트는 염기성 내화물이다.
44. 금속의 상변태시 압력변화에 따른 비등점 상승이 나융점 강하를 알고자 할 때 유용한 관계식
- Clausius - Clapeyron Equation
45. 100g의 구리로 만든 15℃의 열량계가 15℃의 물 200g에 들어 있다. 100℃의 알루미늄 300g을 넣었을 때, 물의 온도가 34.7℃로 되었다면, 알루미늄의 비열은 약 0.21cal/g·℃ 이다. (단, 구리의 비열은 0.090cal/g·℃이다.)
46. 깁스-듀헴식(Gibbs-Duhem equation)은 어떤 경우에 쓰는가?
- 2원계에서 한 성분의 활동도계수를 알고 다른 성분의 활동도계수를 계싼해야 하는 경우
47. 엔트로피의 절대치를 구할 수 있는 근거를 제공하는 법칙은 열역학 제3법칙이다.
48. 황 32kg을 완전연소시키기 위하여 필요한 산소는 32kg이다.
49. 다음 중 발열량이 가장 높은 것
- CH4
- C3H8
- C2H2
- H2S
50. 조연(Pb)의 건식정련 시 제일 먼저 부유물(Dross)로 제거되는 성분은 Cu이다.
51. 25°C에서 3mole의 H2(g)와 1mole의 N2(g)를 섞어서 이상기체 혼합물을 생성할 때 ΔSM(Entropy of mixing)는 약 4.5 cal/K 이다.
52. 탈산원소 중 탈산력이 세기가 큰 것부터 순서대로 나열한 것
Ca > Al > Si > Mn
53. 일정 조성의 계에 대한 헬름홀츠 자유에너지는 부피와 온도를 독립변수로 하는 함수이다.
54. 고체 탄소가 산화하여 이산화탄소가 기체가 되는 반응이 다음과 같을 때, 1000K에서 반응의 형태와 방향 (단, 반응전 산소와 CO₂의 분압은 같다.)
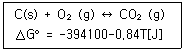
형태 : 발열반응
반응방향 : CO₂ 생성방향
55. 10g의 아연과 20g의 구리를 섞어 이상적으로 균일한 황동을 만들었을 때의 엔트로피 증가는 약 0.5 cal/K 이다. (단, Cu, Zn의 원자량은 각각 63.5, 65.3g/mole 이다.)
10g/65.3=0.153mol(Zn),20g/63.5=0.315mol(Cu)
dS=nR∑XilnXi
dS=(0.153mol+0.315mol)*(1.987)*((0.153/0.468)*ln(0.153/0.468)+(0.315/0.468)*ln(0.315/0.468))
=-0.587cal/k
56. 라울의 법칙에 따르는 이상용액에서 용질물질 B의 활동도 계수 YB는 YB=1이다.
57. 이상기체의 가역단열과정에서 성립되는 관계식 (단, ΔU = 내부에너지변화, q = 열, P = 압력, V = 부피, T = 온도, W = 일)
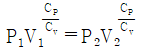
58. A=E-TS 관계식 (단, A : helmholtz 자유에너지, G : Gibbs 자유에너지, H : 엔탈피, E : 내부에너지, S : 엔트로피, T : 온도, P : 압력, V : 부피)
59. 고로에 주로 사용되는 내화재
- 점토질, 탄소질, 고알루미나질
60. 열전도율의 단위는 kcal/m·h·°C 이다.
글을 읽어주셔서 감사합니다.
구독, 좋아요
한 번씩만 눌러주시면 감사하겠습니다.
(비 로그인도 구독, 좋아요 가능하니 눌러주시면 더욱더 열심히 하겠습니다!)







